Teori Kinetik Gas Dan Termodinamika
Teori Kinetik Gas Dan Termodinamika – Pada pembahasan kali ini kami sampaikan materi tentang teori kinetik dan termodinamika. Kedua materi ini merupakan materi mata pelajaran fisika yang diajarkan di kelas XI.
Kita awali dari teori kinetik gas terlebih dahulu. Pada materi ini ada istilah gas ideal. Apa itu gas ideal?
Pengertian Gas Ideal
Gas ideal adalah sekumpulan partikel gas yang tidak saling berinteraksi satu sama lain. Dengan kata lain jarak antar partikel gas ideal sangat berjauhan dan bergerak secara acak. Gas ideal ini mempunyai beberapa sifat, antara lain:
- Partikelnya berjumlah banyak.
- Tidak ada interaksi antarpartikel atau tidak ada gaya tarik menarik antarpartikelnya.
- Jika dibandingkan ukuran ruangan, ukuran partikel gas ideal bisa diabaikan.
- Tumbukan yang terjadi antara partikel gas dan dinding ruangan merupakan tumbukan lenting sempurna.
- Partikel gas tersebar secara merata di dalam ruangan.
- Partikel gas bergerak secara acak ke segala arah.
- Berlaku Hukum Newton tentang gerak.
- Energi kinetik rata-rata molekul gas ideal sebanding dengan suhu mutlaknya.
Baca juga: Teori Mekanika Kuantum
Persamaan Umum Gas Ideal
Ada persamaan umum untuk gas ideal. Berikut persamaan umum yang bisa Anda lihat:

Persamaan Keadaan Gas Ideal
Pada ruang tertutup keadaan suatu gas ideal dipengaruhi oleh beberapa faktor. Seperti tekanan, suhu, volume dan jumlah molekul gas. Ada beberapa hukum yang menjelaskan keterkaitan keempat besaran tersebut. Antara lain Hukum Boyle, Hukum Charles, Hukum Gay-Lussac dan Hukum Boyle-Gay Lussac. Berikut akan dijelaskan singkat keempat hukum tersebut.
Hukum Boyle
Hukum Boyle ini dikemukakan oleh Robert Boyle, seorang ilmuwan asal Inggris. Hukum Boyle menyatakan jika suhu suatu gas dijaga konstan, maka tekanan gas akan berbanding terbalik dengan volumenya. Atau istilah lainnya dapat dinyatakan sebagai hasil kali antara tekanan dan volume suatu gas pada suhu tertentu adalah tetap atau isotermal. Rumus dari Hukum Boyle ini adalah sebagai berikut:

Hukum Charles
Apabila Hukum Boyle membahas mengenai pengaruh tekanan dan volume pada suhu tetap, lain halnya dengan hukum ini. Hukum Charles disampaikan oleh Jacques Charles. Disebutkan bahwa jika tekanan suatu gas dijaga konstan, maka volume gas akan sebanding suhu mutlaknya.
Hukum Charles juga bisa disebut sebagai hasil bagi antara volume dan suhu pada tekanan tetap atau isobar akan bernilai tetap. Berikut adalah rumus dari hukum Charles.

Hukum Gay-Lussac
Di tahun 1802 Joseph Louis Gay-Lussac, seorang ilmuwan Kimia asal Prancis mengemukakan Hukum Gay-Lussac. Hukum Gay-Lussac memuat pernyataan jika volume suatu gas dijaga konstan, tekanan gas akan sebanding dengan suhu mutlaknya. Artinya proses yang berlangsung dalam keadaan isokhorik atau volume tetap. Berikut adalah rumus matematis Hukum Gay-Lussac.
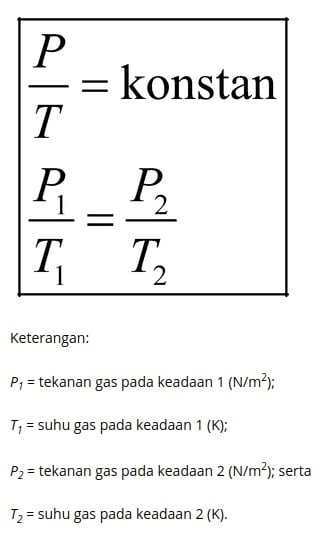
Hukum Boyle-Gay Lussac
Hukum ini merupakan hasil kali antara tekanan dan volume dibagi suhu pada sejumlah partikel mol gas adalah tetap.Berikut adalah rumus dari hukum Boyle-Gay Lussac.

Tekanan Gas Ideal
Perlu diketahui, keberadaan gas di ruang tertutup bisa mengakibatkan adanya tekanan. Tekanan itu disebabkan adanya tumbukan antara partikel gas dan dinding tempat gas berada. Untuk mengetahui besarnya tekanan gas di ruang tertutup dapat dihitung dengan rumus di bawah ini:

Energi Kinetik Gas Ideal
Energi kinetik gas ideal disebabkan oleh adanya gerakan partikel gas di dalam sebuah ruangan. Untuk diketahui, gas selalu bergerak dengan kecepatan tertentu. Kecepatan itulah yang nantinya berpengaruh terhadap energi kinetik gas. Rumus energi kinetik gas ideal bisa dilihat di bawah ini.

Berdasarkan persamaan di atas, didapat persamaan untuk kecepatan efektif gas pada ruang tertutup. Sedangkan persamaan kecepatannya adalah:

Termodinamika
Setelah membahas tentang teori kinetik gas, kini kita bahas tentang termodinamika. Ilmu termodinamika adalah gambaran usaha untuk mengubah kalor menjadi energi serta sifat-sifat pendukungnya. Seperti yang diketahui kalor merupakan perpindahan energi yang disebabkan oleh perbedaan suhu. Termodinamika berhubungan dengan fisika energi, panas, kerja, entropi dan kespontanan proses.
Tidak hanya itu, termodinamika juga berkaitan dengan mekanika statik. Termodinamika mempelajari suatu pertukaran energi dalam bentuk kalor dan kerja, sistem pembatas maupun lingkungan.
Baca juga: Teori Asam Bawa Lewis
Penerapan termodinamika bisa dilihat dalam banyak hal. Salah satunya adalah pada tubuh manusia, kegiatan meniup kopi panas, perkakas elektronik, Refrigerator, mobil, pembangkit listrik maupun industri. Itu semua merupakan beberapa peristiwa termodinamika yang familiar dengan kita.
Prinsip-Prinsip Termodinamika

Penerapan prinsip-prinsip termodinamika mencakup Mekanika, Panas, dan Kalkulus Diferensial pada ilmu pengetahuan. Anda bisa melihat penerapan prinsip termodinamika pada gambar di atas.

Sedangkan gambar diatas menunjukkan bahwa penyelesaian suatu masalah secara termodinamika dilakukan dalam beberapa tahapan, di antaranya:
- Formulasi problem ke dalam besaran & bentuk termodinamika. Hal ini yang dikatakan sebagai mengubah bahasa dalam problem ke dalam bahasa termodinamika, kemudian merumuskannya dengan menggunakan besaran-besaran termodinamika.
- Evaluasi sifat dan fungsi termodinamika, berarti melakukan analisis terhadap formulasi yang telah disusun pada langkah pertama (1). Tahap ini membutuhkan pemahaman pengetahuan termodinamika yang memadai agar tidak terjadi kesalahan persepsi terhadap arah atau tujuan problema tersebut.
- Penyelesaian problem termodinamika. Pada tahap ini dibutuhkan dukungan pengetahuan matematika/kalkulus (diferensial, integral) sehingga dapat diperoleh jawaban yang valid atau bisa dipertanggungjawabkan.
Ketiga langkah penyelesaian termodinamika tersebut harus berpijak pada dalil-dalil atau kaidah-kaidah dalam termodinamika.
Sistem Termodinamika
Sistem Termodinamika adalah bagian dari jagat raya yang diperhitungkan. Sebuah batasan yang nyata ataupun imajinasi memisahkan sistem dengan jagat raya yang disebut lingkungan. Klasifikasi sistem termodinamika berdasarkan sifat batas sistem lingkungan dan perpindahan materi, kalor dan entropi antara sistem dan lingkungan.
Jika dilihat berdasarkan jenis pertukaran yang terjadi antara sistem dan lingkungan, ada tiga jenis sistem yang bisa kita ketahui. Antara lain sistem tertutup, sistem terisolasi dan sistem terbuka.
Sistem Tertutup
Pada sistem ini terjadi pertukaran energi panas dan kerja namun tidak terjadi pertukaran benda dengan lingkungan. Contohnya adalah rumah hijau, di mana terjadi pertukaran panas namun tidak terjadi pertukaran kerja dengan lingkungan. Ada dua sifat pembatas yang menentukan apakah suatu sistem terjadi pertukaran panas, kerja atau keduanya, yakni:
- Pembatas Adiabatik: tidak memperbolehkan pertukaran panas
- Pembatas Rigid: tidak memperbolehkan pertukaran kerja.
Sistem Terisolasi
Pada sistem terisolasi tak terjadi pertukaran panas, benda atau kerja dengan lingkungan. Misalnya adalah wadah terisolasi seperti tabung gas terisolasi.
Sistem Terbuka
Dalam sistem ini terjadi pertukaran energi panas dan kerja dan benda dengan lingkungan. Sebuah pembatas yang memperbolehkan pertukaran benda disebut permeabel. Contoh dari sistem terbuka adalah samudera.
Keadaan Termodinamika
Saat sistem dalam keadaan seimbang pada kondisi yang ditentukan, maka hal ini disebut dalam keadaan pasti atau keadaan sistem.
Banyak sifat dari sistem dispesifikasikan untuk keadaan termodinamika tertentu. Properti yang tidak tergantung dengan jaluru di mana sistem itu membentuk keadaan tersebut disebut fungsi keadaan dari sistem. Bagian berikutnya dalam seksi ini hanya mempertimbangkan properti yang merupakan fungsi keadaan.
Jumlah properti minimal yang perlu dispesifikasikan untuk menjelaskan keadaan dari sistem tertentu ditentukan oleh hukum fase Gibbs. Umumnya seseorang berhadapan dengan properti sistem yang lebih besar dari jumlah minimal tersebut. Pengembangan hubungan antara properti dari keadaan yang berlainan dimungkinkan.
Hukum Dasar Termodinamika
Ada empat Hukum Dasar termodinamika yang perlu kita ketahui. Yakni Hukum Awal, Hukum Pertama Termodinamika, Hukum Kedua Termodinamika dan Hukum Ketiga Termodinamika.
Hukum Awal (Zeroth Law) Termodinamika
Hukum awal menjelaskan bahwa dua sistem dalam keadaan setimbang dengan sistem ketiga, maka ketiganya dalam saling setimbang satu dengan lainnya. Hukum tersebut dimasukkan sesudah hukum pertama.
Hukum Pertama Termodinamika
Hukum ini menyatakan perubahan energi dalam dari suatu sistem termodinamika tertutup, sama dengan total dari jumlah energi kalor yang disuplai ke dalam sistem dan kerja yang dilakukan oleh sistem. Hukum tersebut diuraikan menjadi proses dengan Isokhorik, Isotermik, Isobarik, dan adiabatik.
Hukum Kedua Termodinamika
Hukum ini berhubungan dengan entropi. Tidak ada bunyi untuk hukum kedua termodinamika, yang ada hanyalah pernyataan kenyataan eksperimental yang dikeluarkan oleh Kelvin-Planck dan Clausius.
Pernyataan Clausius: tidak mungkin suatu sistem apapun bekerja sedemikian rupa sehingga hasil satu-satunya adalah perpindahan energi sebagai panas dari sistem dengan temperatur tertentu ke sistem dengan temperatur yang lebih tinggi.
Pernyataan Kelvin-Planck: tidak mungkin suatu sistem beroperasi dalam siklus termodinamika dan memberikan sejumlah netto kerja ke sekeliling sambil menerima energi panas dari satu reservoir termal.(sumber Fundamentals of engineering thermodynamics (Moran J., Shapiro N.M. – 6th ed. – 2007 – Wiley) Bab5).
Hukum Ketiga Termodinamika
Hukum ini berhubungan dengan temperatur nol absolut. Hukum tersebut menyatakan bahwa pada saat suatu sistem pencapai temperatur nol absolut, seluruh proses akan berhenti dan entropi sistem akan mendekati nilai minimum. Hukum tersebut juga menyatakan bahwa entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol.



